MODELOS ATOMICOS
DEMOCRITO:450 a. C.), el primer modelo atómico, postulado por el filósofo griego Demócrito. Esta era considerada como indivisible e indestructible, se la llamaba la partícula más pequeña de la materia.muere el 360 a.C
DALTON:1803)fue el primer modelo atómico con bases científicas, propuesto entre 1803 y 1807 por John Dalton,aunque el autor lo denominó más propiamente "teoría atómica" o "postulados atómico y su modeló atómicos fue
CÚBICO
THONSON :(1904), o modelo del pudin, donde los electrones son como las "frutas" dentro de la "masa" positiva. quien descubrió el electrón en 1897, pocos años antes del descubrimiento del protón y del neutrón. En el modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo
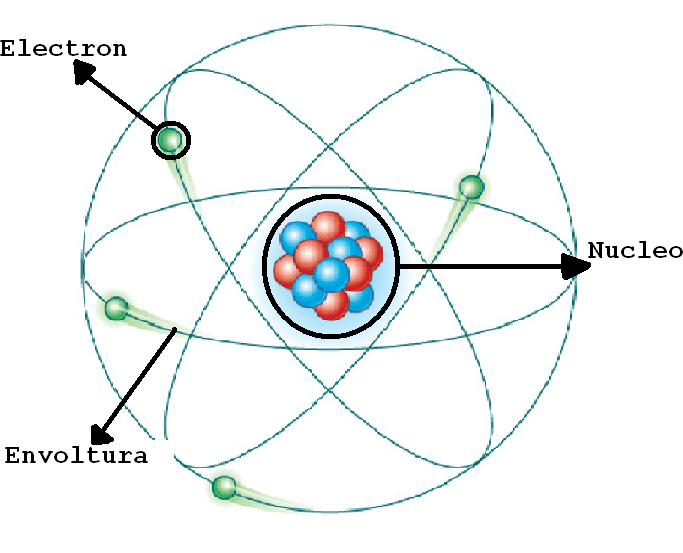
RUTHERFORD:teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neerlandés Ernest Rutherford para explicar los resultados de su «experimento de la lámina de oro», realizado en 1911.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extra-nuclear se encuentran los electrones de carga negativa
BORH: es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados. Dado que la cuantización del momento es introducida en forma ad hoc, el modelo puede considerarse transicional en cuanto a que se ubica entre la mecánica clásica y l
.
.

SEMMERFELD: El modelo atómico de Bohr funcionaba muy bien para el átomo de hidrógeno, sin embargo, en los espectros realizados para átomos de otros elementos se observaba que electrones de un mismo nivel energético tenían distinta energía, mostrando que existía un error en el modelo. Su conclusión fue que dentro de un mismo nivel energético existían sub niveles, es decir, energías ligeramente diferentes. Además desde el punto de vista teórico



 .
.